「細胞競合」の分子機構とその生理的役割
近年、生態系で見られるような生物個体間の生存競争に類似した現象が、多細胞生物を構成する細胞間のレベルにも存在することが明らかとなり、「細胞競合」と名付けられました。細胞競合とは、同種の細胞間で相対的に「適応度」の高い細胞(勝者)が低い細胞(敗者)を積極的に集団から排除する現象です。細胞競合は、がんのもとになる変異細胞を排除することでがんの発生を抑制したり、生体内の不良細胞を除去することで老化を抑制したりするような役割をもつと考えられています。私たちの研究室では、ショウジョウバエを用いて様々な細胞競合のモデル系を確立し、細胞競合の分子機構とその生理的役割の解析を進めています。 細胞競合は、その役割や分子機構から「がん抑制型」「Minute型」「スーパーコンペティション」の3つのタイプに分けることができます。
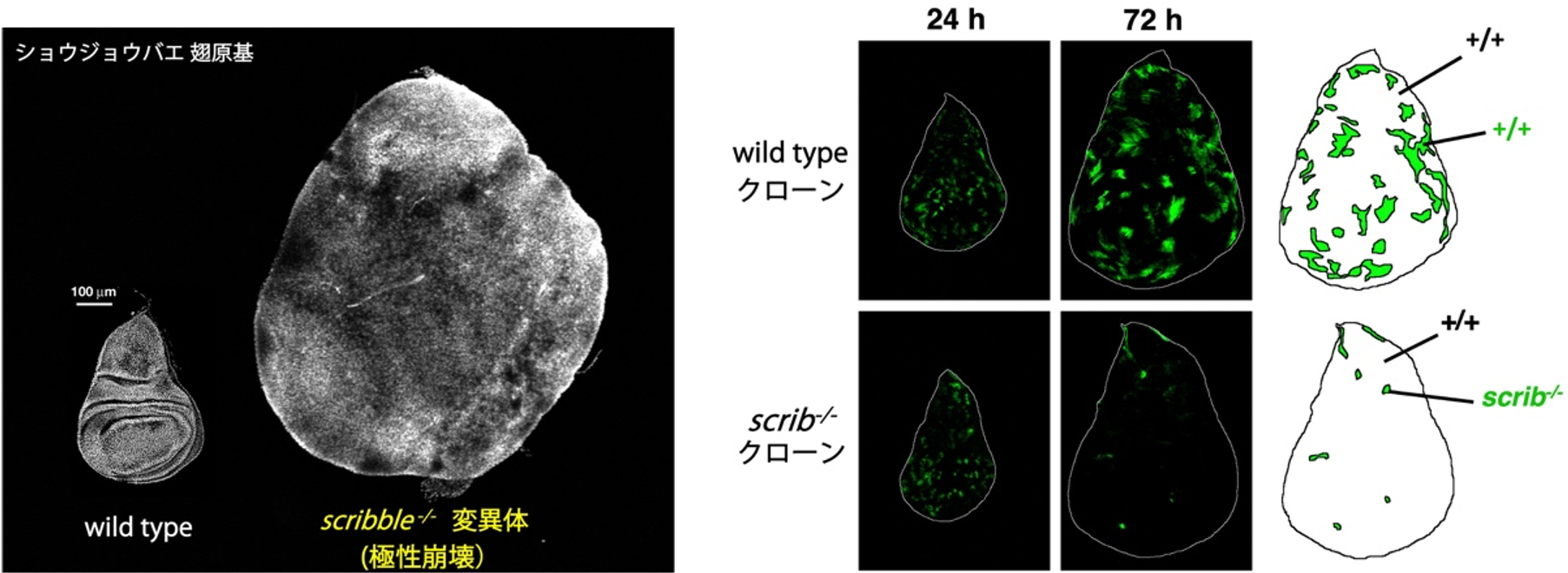
「がん抑制型細胞競合」とは、細胞極性が崩壊したようながん原性の変異細胞が正常細胞に囲まれると細胞競合によって排除される現象です。 がんは様々な臓器の表面にある上皮細胞から生まれます。正常な上皮細胞は頂端-基底軸に沿った細胞極性(頂底極性)をもっていますが、この極性が崩壊すると細胞は増殖しやすくなりがん化が促進されます。例えば、ショウジョウバエの複眼原基(上皮組織)を構成する全ての細胞で極性遺伝子scribが変異することによって極性崩壊が起こると、細胞は過剰に増殖して巨大な腫瘍塊を形成します。興味深いことに、このscrib変異細胞は正常細胞に囲まれると腫瘍化せず、むしろ細胞死を起こして組織から排除されることがわかりました (Igaki et al. Dev Cell, 2009)。この現象は、現在では「がん抑制型細胞競合(tumor-suppressive cell competition)」と呼ばれています。がん抑制型細胞競合では、免疫細胞のように異物を排除するための特殊な能力をもった細胞が働くのではなく、いわゆる「普通の」細胞が近隣のがん細胞を認識して排除するという新しい現象です。この発見を起点として、ショウジョウバエの強力な遺伝学を応用して生体レベルでの解析を行い、がんを抑制するタイプの細胞競合は①正常細胞による極性崩壊細胞の貪食、②極性崩壊細胞に対する増殖抑制と細胞死の誘導、③極性崩壊細胞の組織からの排出、という3つの現象が協調的に進行することで駆動されることを明らかにしました(Ohsawa et al. Dev Cell, 2011, Vaughen and Igaki Dev Cell, 2016, Yamamoto et al. Nature, 2017など)。さらに、この細胞競合は隣接する細胞間の相互作用のみならず、離れた細胞や臓器間のシグナル伝達によっても制御されることを見いだしました(Katsukawa et al. Curr Biol, 2018, Sanaki et al. Dev Cell, 2020など)。極性崩壊によって駆動される細胞競合の細胞内シグナルの制御機構や、細胞競合を制御する臓器間のシグナル、さらにはこの現象の生理的役割を解き明かしていきたいと考えています。
「Minute型細胞競合」とは、MorataとRipollが1975年にショウジョウバエで最初に報告した細胞競合で、リボソームタンパク質遺伝子をヘテロに欠失した変異細胞(Minute変異細胞)が野生型細胞に囲まれると排除されるという現象です。のちに、ユビキチンリガーゼMahj/VprBP遺伝子やRNAヘリカーゼHel25E遺伝子の変異細胞も同様にMinute型細胞競合によって排除されることが明らかになりました。このタイプの細胞競合は、単独では普通に生存できる(一見、野生型細胞と全く区別がつかない)不良細胞が正常細胞と共存すると細胞死を起こして排除されるもので、組織中の細胞集団を最適化する役割を果たしていると考えられます。私たちの研究室では、このタイプの細胞競合において、不良細胞が正常細胞に近接するとオートファジー依存的な細胞死を引き起こして排除されることを見いだしました(Nagata et al, Dev Cell, 2019)。また、細胞競合の敗者となる不良細胞では、転写因子Xrp1の発現誘導を介して小胞体膜に局在するキナーゼPERKが翻訳開始因子eIF2をリン酸化し、これによりタンパク質合成がグローバルに低下して不良細胞が排除されることを見いだしました(Ochi et al, PLoS Genet, 2021)。細胞競合の敗者でどのようにしてXrp1が発現誘導されるのか、また勝者-敗者細胞間のタンパク質合成能の差がどのようにして敗者細胞のオートファジーや細胞死を誘導するのかはいまだ不明で、今後の重要な課題です。「スーパーコンペティション」とは、がん遺伝子Mycを高発現する、あるいはがん抑制経路Hippo経路に変異をもつようながん原性の変異細胞が周囲の正常細胞に細胞死を誘導して組織を拡大していく細胞競合現象です。ヒトのがんにおいても、スーパーコンペティションによってがんの進展が起こると推測されています。私たちは、スーパーコンペティションにおいてがん原性細胞のタンパク質合成の上昇が周囲の正常細胞にオートファジー依存的な細胞死を誘導し、腫瘍形成を促進することを見いだしました(Nagata et al, Curr Biol, 2022)。さらに、このタンパク質合成の上昇はHippo経路の下流で発現誘導されるmicroRNAであるbantamによって引き起こされていることを見いだしました。bantamの発現上昇のみでスーパーコンペティションが起こることもわかりました。bantamがタンパク質合成を上昇させる機構、タンパク質合成の上昇が隣接する野生型細胞にオートファジーや細胞死を引き起こす機構は未だ不明であり、今後の重要な課題です。
当研究室では、これらの細胞競合に加えて、さまざまな遺伝子変異によって引き起こされる細胞競合現象を見いだしています。それらの細胞競合の分子機構を明らかにするとともに、細胞競合が正常発生やがん、老化をどのように制御するのか、その生理的役割や分子機構を明らかにしていきます。
Recent publications:
*Nagata R, Akai N, Kondo S, Saito K, Ohsawa S and Igaki T
“Yorkie drives supercompetition by non-autonomous induction of autophagy via bantam microRNA in Drosophila“
Current Biology 2022 Feb 07 [PubMed]
Ochi N, Nakamura M, Nagata R, Wakasa N, Nakano R and Igaki T.
"Cell competition is driven by Xrp1-mediated phosphorylation of eukaryotic initiation factor 2α"
PLOS Genetics 2021 Dec 6;17(12):e1009958 [PubMed]
Sanaki Y, Nagata R, Kizawa D, Léopold P and Igaki T.
"Hyperinsulinemia drives epithelial tumorigenesis by abrogating cell competition"
Developmental Cell 2020 May 18;53(4):379-389 [PubMed]
Nagata R, Nakamura M, Sanaki Y and Igaki T.
"Cell competition is driven by autophagy"
Developmental Cell 2019 Oct 7;51(1):99-112 [PubMed]
Katsukawa M, Ohsawa S, Zhang L, Yan Y and Igaki T.
"Serpin Facilitates Tumor-Suppressive Cell Competition by Blocking Toll-Mediated Yki Activation in Drosophila"
Current Biology 2018 May 15 [PubMed]
Yamamoto M, Ohsawa S, Kunimasa K and Igaki T.
"The ligand Sas and its receptor PTP10D drive tumor-suppressive cell competition"
Nature 2017 Feb 9;542 (7640):246-250 [PubMed]
Vaughen J and Igaki T.
"Slit-Robo Repulsive Signaling Extrudes Tumorigenic Cells from Epithelia"
Developmental Cell 2016 Dec 19;39 (6):683-695 [PubMed]
Ohsawa S, Sugimura K, Takino K, Xu T, Miyawaki A, Igaki T.
"Elimination of oncogenic neighbors by JNK-mediated engulfment in Drosophila"
Developmental Cell 20, 315-328 (2011) [PubMed]
Igaki T, Pastor-Pareja JC, Aonuma H, Miura M, Xu T.
"Intrinsic tumor suppression and epithelial maintenance by endocytic activation of Eiger/TNF signaling in Drosophila"
Developmental Cell 16, 458-465 (2009) [PubMed]