細胞間コミュニケーションを介した腫瘍形成・悪性化機構
がんの発生や悪性化には、「がん遺伝子」や「がん抑制遺伝子」といった遺伝子変異の蓄積だけではなく、がん細胞を取り巻く微小環境が重要な役割を果たすことがわかっています。また近年のゲノム解析技術の進展により、がんは1種類の腫瘍細胞ではなく異なる遺伝子変異をもった複数の腫瘍細胞によって形成される「腫瘍内不均一性」と呼ばれる組織の状態を示すこともわかってきました。このような組織微小環境における細胞同士のコミュニケーションが、がん細胞の浸潤・転移能、治療抵抗性、再発に深く関わっていると考えられています。しかし、細胞間コミュニケーションによるがんの発生や進展の分子機構にはいまだ不明な点が多く、その仕組みはまだ良くわかっていません。
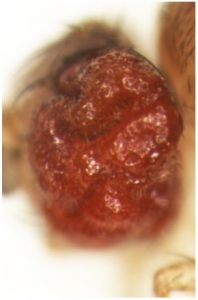
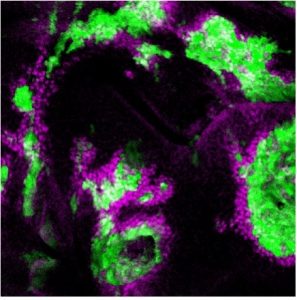
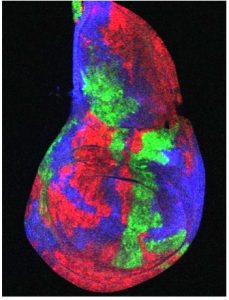
これまでに当研究室では、ショウジョウバエ腫瘍形成・悪性化モデルを確立し(Igaki et al, Curr Biol, 2006)、腫瘍細胞とその周囲の細胞とのコミュニケーションを介したがんの発生・悪性化機構の解析を進めてきました。例えば、がん遺伝子Rasの活性化とミトコンドリアの機能障害を同時に起こした変異細胞が炎症性サイトカインUpd(IL-6ホモログ)を産生・分泌し、その周辺の良性腫瘍をHippo経路依存的に悪性化することを明らかにしました(Ohsawa et al, Nature, 2012; Nakamura et al, Nat. Commun, 2014)。また、がん遺伝子Srcを活性化した変異細胞がHippo経路を介して周辺細胞の過剰な増殖を引き起すことを見いだしました(Enomoto and Igaki, EMBO Rep, 2013)。このSrcを活性化した変異細胞はRasを活性化した変異細胞と隣接すると、両細胞の境界上でNotchシグナルの活性化が起こり、これを起点としてRasとSrcを活性化した腫瘍細胞が共に悪性能を獲得することを明らかにしました(Enomoto et al, Dev Cell, 2021)。
一方で当研究室では、細胞同士の「協調」によるがんの発生・悪性化の基本原理の解明と並行して、これまでに私たちが確立したショウジョウバエ悪性化腫瘍モデルを用いて、がんの発生を抑制する分子機構の解明にも取り組んでいます。例えば、腫瘍細胞がアミノ酸トランスポーターJhI-21(Lat1ホモログ)を介してグルタミンを積極的に細胞内に取り込むことで悪性化している現象を発見し、この腫瘍をもつ個体にLat1活性を阻害する薬剤を作用させると腫瘍サイズが劇的に縮小することを明らかにしました(Bojie et al, PLoS Genet, 2021)。また、miR-306 とmiR-79と呼ばれる2種類のマイクロRNAはE3ユビキチンリガーゼRNF146を抑制しJNKシグナル依存的な細胞死を引き起こすことで腫瘍を組織から除去する作用があることを明らかにしました(Wang et al, eLife, 2022)。
これらのショウジョウバエ遺伝学を駆使した解析系を利用して、がんの発生や悪性化の分子機構について組織・個体レベルでの解明を目指しています。一方で、がんを制御する細胞間コミュニケーションが損傷組織の修復や再生にも貢献していることも見てきました。そこで細胞間コミュニケーションの視点から組織修復の仕組みを明らかにする研究も進めています。
Recent publications:
Wang Z, Xia X, Li J and Igaki T.
"Tumor elimination by clustered microRNAs miR-306 and miR-79 via noncanonical activation of JNK signaling"
eLife 2022 11: e77340 [PubMed]
Bojie C, Nakamura M, Sando Y, Kondo T, Ohsawa S and Igaki T.
"JNK and Yorkie drive tumor malignancy by inducing L-amino acid transporter 1 in Drosophila"
PLoS Genetics 2021 17(11): e1009893 [PubMed]
Enomoto M, Takemoto D and Igaki T.
"Interaction between Ras and Src clones causes interdependent tumor malignancy via Notch signaling in Drosophila"
Developmental Cell 2021 56(15):2223-2236.e5 [PubMed]
Nakamura M, Ohsawa S and Igaki T.
“Mitochondrial defects trigger proliferation of neighbouring cells via a senescence-associated secretory phenotype in Drosophila"
Nature Communications 2014 5:5264. [PubMed]
Enomoto M and Igaki T.
"Src controls tumorigenesis via JNK-dependent regulation of the Hippo pathway in Drosophila"
EMBO Reports 2013 14(1):65-72 [PubMed]
Ohsawa S, Sato Y, Enomoto M, Nakamura M, Nakamura M, Betsumiya A and Igaki T.
"Mitochondrial defect drives non-autonomous tumour progression via Hippo signalling in Drosophila"
Nature 2012 490: 547-551 [PubMed]
Igaki T, Pagliarini R and Xu T.
"Loss of cell polarity drives tumor growth and invasion through JNK activation in Drosophila"
Current Biology 2006 16(11):1139-46 [PubMed]