メンバー
|
北島 智也客員教授 |
tomoya.kitajima*riken.jp 教員情報 |
|---|---|
|
藤澤 茂義客員教授 |
shigeyoshi.fujisawa*riken.jp |
|
髙里 実客員准教授 |
minoru.takasato*riken.jp 教員情報 |
|
小幡 史明客員准教授 |
fumiaki.obata*riken.jp 教員情報 |
|
小長谷 有美客員准教授 |
yumi.konagaya*riken.jp 教員情報 |
|
近藤 武史客員准教授 |
takefumi.kondo*riken.jp 教員情報 |
|
竹岡 彩客員准教授 |
aya.takeoka*riken.jp |
- @マークを*に置き換えておりますのでご注意ください
アクセス
北島研究室
理化学研究所(神戸キャンパス) 生命機能科学研究センター 発生・再生研究棟C棟
藤澤研究室
理化学研究所 脳神経科学研究センター(埼玉県和光市) 脳神経回路遺伝学棟
髙里研究室
理化学研究所(神戸キャンパス) 生命機能科学研究センター 発生・再生研究棟A棟
小幡研究室
理化学研究所(神戸キャンパス) 生命機能科学研究センター 発生・再生研究棟A棟
小長谷研究室
理化学研究所(神戸キャンパス) 生命機能科学研究センター 発生・再生研究棟A棟
近藤研究室
理化学研究所(神戸キャンパス) 生命機能科学研究センター 発生・再生研究棟C棟
竹岡研究室
理化学研究所 脳神経科学研究センター(埼玉県和光市) 脳神経回路遺伝学棟
神戸地区のキャンパスマップはこちら
北島研究室 研究概要
研究内容
卵母細胞は減数分裂を行うことで卵子となります。卵子は受精して細胞分裂を繰り返すことで、やがて個体となります。私たちの研究室では、マウス卵のハイスループットかつ高解像度ライブイメージング技術、顕微操作技術、遺伝学的手法を組み合わせることで、卵母細胞の減数分裂と受精卵の体細胞分裂における染色体分配を研究しています。卵母細胞が行う最初の分裂が減数第一分裂です。このときの染色体分配はエラーが多く、その頻度は母体年齢とともに上昇します。続いて受精時に減数第二分裂が、受精後にはDNA複製を経て体細胞分裂が行われ、それぞれで染色体が分配されます。私たちは、これら3回の連続した細胞分裂における、異なる染色体分配のロジックを明らかにしていきます。卵母細胞の減数第一分裂における染色体分配の機構を明らかにし、なぜこの分裂で特にエラーが多く、しかも年齢とともにその頻度が上昇するのかを理解します。続く減数第二分裂、体細胞分裂のそれぞれの機構と比較することで、細胞が染色体分配の戦略を柔軟に使い分ける様を見出していきます。これらの研究から得られた成果を、さらに生殖医療分野との共同研究に活かしていきます。
主な研究項目
- マウス卵母細胞の減数分裂における染色体分配の分子機構の解明
- ライブイメージングを用いた染色体動態の解析
- 老化による卵母細胞の染色体分配機構の破綻
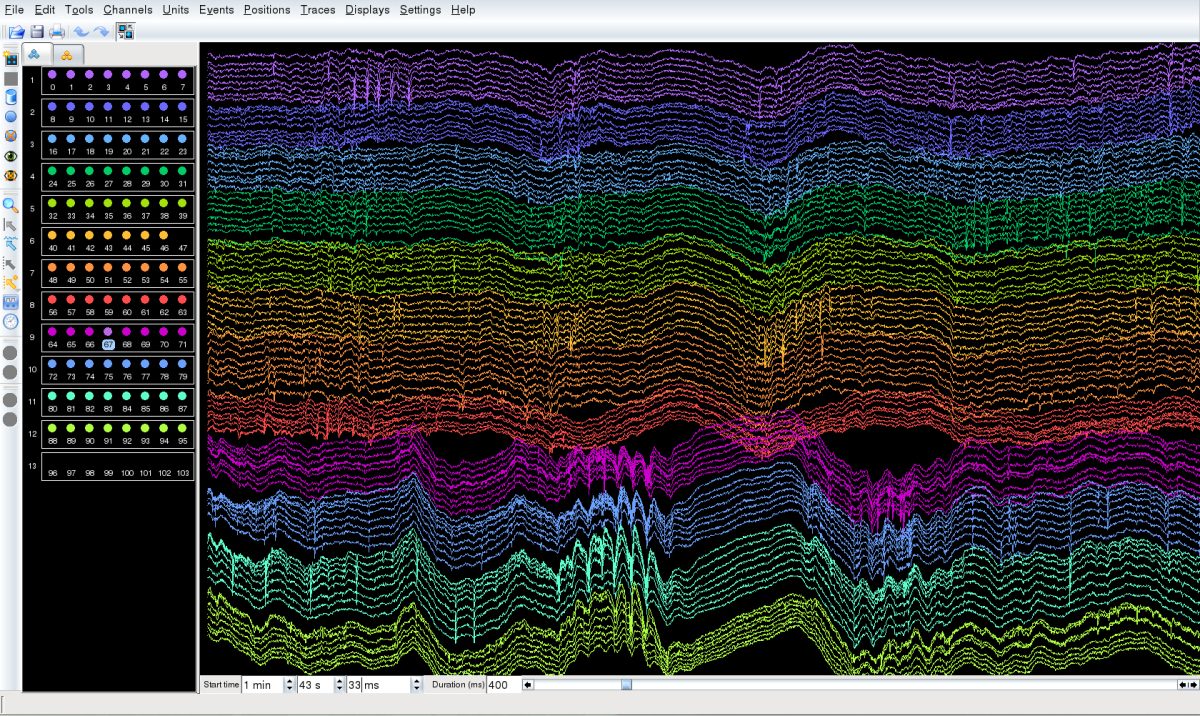
藤澤研究室 研究概要
研究内容
主な研究項目
- 海馬と嗅内皮質における空間ナビゲーション機能のメカニズム解明
- 神経回路の情報処理におけるオシレーションの役割の解明
- 光遺伝学手法と電気生理学手法を融合させた神経活動操作技術の開発
髙里研究室 研究概要
研究内容
再生医療研究の究極の目標とはなんだろうか。私たちはこの目標を、試験管内でヒト多能性幹細胞を分化誘導し、任意の臓器を完全な形で創り上げる事だと考えています。これまでに私たちはヒト多能性幹細胞から中間中胚葉を分化誘導し、そこから糸球体、尿細管、集合管、血管、間質組織を内包する腎臓オルガノイドを作りました。しかし、サイズ、構造的複雑性、成熟度の点から実際のヒト腎臓と比較すると、腎臓オルガノイドはまだ未完成であると言わざるを得ません。当研究室では、この腎臓オルガノイドの作製系をブラッシュアップし、将来的に移植可能なレベルの3次元腎臓組織を試験管内で構築することを目指すと共に、膀胱など、腎臓と接続するその他の臓器のオルガノイドの作製も行います。また、私たちの持つ、中胚葉・腎臓誘導系から新たな知見を得て、これをヒト発生学へフィードバックすることを目指します。ヒト多能性幹細胞から腎臓細胞までの分化誘導過程にはマウス発生学では説明できない現象もあります。分化誘導過程の細胞の挙動を試験管内で詳しく観察することで、ヒトの中内胚葉系臓器や尿路系臓器の発生メカニズムを解明します。
主な研究項目
- シングルセルRNA-seq解析を用いて、多能性幹細胞の細胞運命決定メカニズムを解明する
- 上皮と間葉の幹細胞を相互作用させ、自己組織化させることで、臓器を形成させる
- ヒトES/iPS細胞を分化誘導し、腎臓や膀胱などの3次元組織オルガノイドを作製する
- 遺伝性腎臓病の患者由来のiPS細胞から腎臓オルガノイドを作製し、病態モデルを確立する
- オルガノイドの応用利用を可能とするために、オルガノイドの血管化・成熟化を促進する手法を開発する
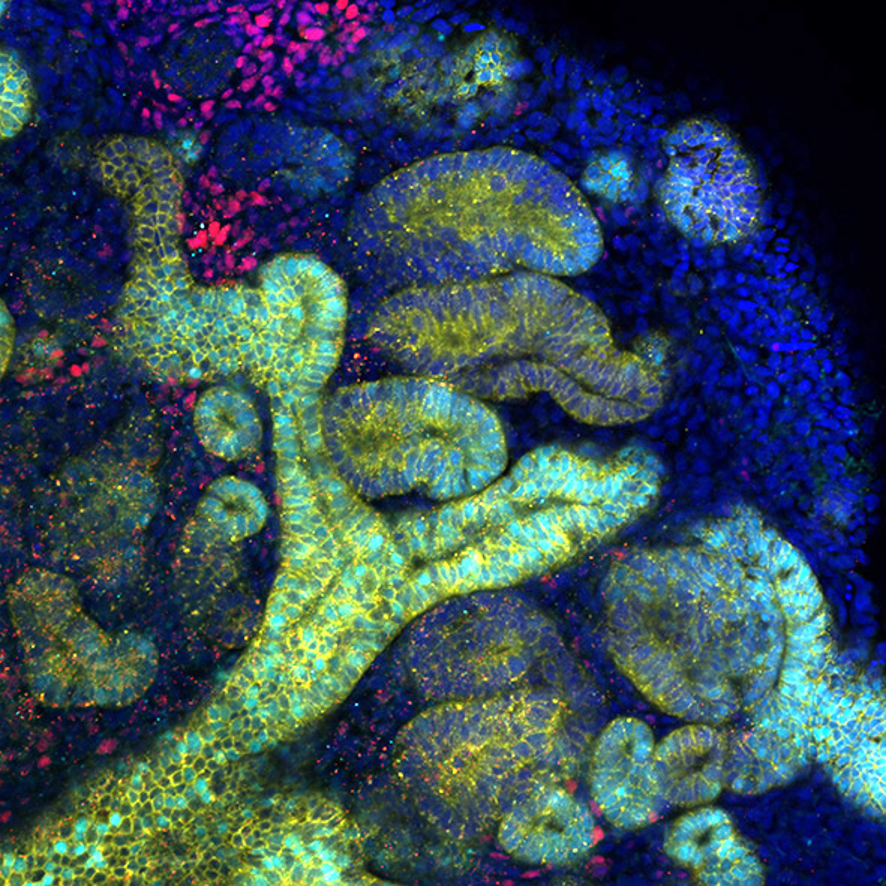
ヒトiPS 細胞から作製した腎臓オルガノイド:ネフロン前駆細胞(赤)と集合管前駆細胞(黄と水色)の両方が存在する。尿細管(黄のみ)も発生している。
研究紹介動画
腎臓オルガノイドを下から上へと スキャンした動画。集合管(緑と黄)、遠位尿細管(黄のみ)、近位尿細管(赤)、糸球体(緑のみ)の連続した腎構造が確認できる。
小幡研究室 研究概要
研究内容
我々は生まれてから死ぬまでほぼ毎日、食事をとります。あらゆる動物において、成長し老化していく過程において常に食事からの栄養を必要とします。我々の健康寿命は、食環境により大きく影響されます。食は栄養素として直接、あるいは腸内細菌を介して間接的に動物の代謝生理恒常性に寄与しますが、その詳しい分子機構の理解は立ち遅れています。当研究室では、食餌によって変化する各種栄養素や腸内細菌の生理機能を研究しています。また、発生・発達期に一過的に摂取する食餌が生涯にわたって健康状態に影響する機構も明らかにしようとしています。寿命の短いショウジョウバエを利用し、生物の老化・寿命を規定する普遍的な食理学的メカニズムを解明します。
我々の研究では、個体が持つ恒常性の総合力を示す指標としての寿命に着目しています。どのような要因がどのように寿命を決定するのか、そのメカニズムを一つ一つ丁寧に紐解いていく作業です。老化研究をおこなう上では、より単純で、かつ寿命の短い生物を利用するのが賢明です。我々が利用しているのは、寿命が2ヶ月と短いショウジョウバエです。ショウジョウバエは強力な遺伝学が利用でき、また研究室での飼育も安価で容易です。倫理的な問題も少なく、数をこなさなければならない寿命測定には最適です。生物の普遍的かつ基本的なメカニズムを知るには、シンプルな生き物としてのショウジョウバエが最適だと考えます。
これまでの生物医学は、いかに病気を治すか、あるいは、病気にならないかということを目指してきたように思います。しかし、健康であることと病気でないことは、似ているようで違います。生物には本来的に健康になろうとする力があるように思います。我々の研究では、そのような生物が持つ恒常性維持の基本的なメカニズムを明らかにしようとしています。
主な研究項目
- 栄養素や腸内細菌叢の生理機能解明
- 発生・発達期環境による恒常性制御機構の解明
- アミノ酸による健康寿命制御機構の解明
- 熱耐性の分子機構解明
- 摂食行動・吸血行動の分子基盤解明
小長谷研究室 研究概要
研究内容
成体組織では常に新陳代謝が行われ、組織恒常性を保っています。中でも腸管上皮は最も新陳代謝の速い組織のひとつで、マウスでは3~5日間のうちに新しい上皮細胞へと入れ替わります。腸管上皮の分化過程における正確な細胞増殖制御は、組織恒常性維持に極めて重要であり、その破綻が組織の萎縮やがん化につながることが知られています。
腸管上皮においてLgr5陽性の幹細胞は約24時間に1回分裂し、一過的増殖細胞を生み出します。そうして生まれた一過的増殖細胞は、Lgr5陽性の幹細胞と比べて約2倍の細胞周期速度で4~6回分裂します。その後一過的増殖細胞は、吸収系または分泌系細胞への終末分化にともなって細胞周期を遅らせ、最終的には細胞周期から完全に逸脱します。驚くべきことに、以上のような腸管上皮おける細胞周期についての記述は今から25年も前に報告されているにもかかわらず、技術的な制約から、腸管上皮細胞が分化にともなって細胞増殖速度を調整する分子機構の解明は全くと言ってよいほど進んでいません。
そこで当研究室ではマウス腸管上皮をモデルとして、腸オルガノイドと組織の多色イメージング、定量的な解析や数理モデルを用いて、幹細胞が一過的増殖細胞を経て終末分化する際に細胞増殖速度を調整する分子機構を解明する。これらの研究により、組織恒常性異常に対する普遍的かつ根本的な治療標的が明らかになる。
主な研究項目
- マウス腸管上皮における細胞増殖と分化の協調的制御についての解析
- マウス腸管上皮におけるメカニカルセンシングが幹細胞維持に果たす役割の解析
- 機械学習に基づくタンパク質構造モデリングを用いた蛍光レポーターの開発
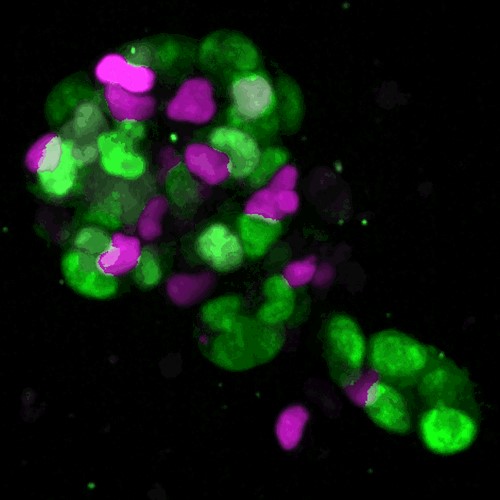
細胞周期レポーターFUCCIを発現する腸オルガノイド
近藤研究室 研究概要
研究内容
発生はダイナミックで美しい現象で、全体としてはとても正確に進行します。一方で、細胞レベルや遺伝子レベルといった細部ではある程度の不確かさが見られます。私たちは、この全体としての発生の正確性を保証する仕組みを解き明かしたいと考えています。
動物の体は適切な「形」と「機能」を獲得した器官が組み合わさることによって成り立っています。発生過程において、形は組織が秩序だって変形を繰り返すことにより作り上げられます。また、器官の機能は細胞の性質に依存しており、器官ごとに細胞は適切に分化し、生理的役割を発揮するための機能を獲得します。発生過程においてこれらの物理的・生化学的な現象は同時に進行しています。つまり、器官形成における自己組織化メカニズムを理解するためには、それぞれがどのようなダイナミクスで進行しているのか、両者が時空間的にどのように影響しあっているのか、それによってどのように「形」と「機能」の調和が成し遂げられるのか、を理解しなければならないと考えています。
私たちの研究室では、発生を遺伝子発現・細胞分化と形態形成の間での双方向性の情報フィードバックを基盤としたゲノム-細胞-組織の多階層ネットワークシステムとして捉え、1細胞ゲノミクスやイメージングなどを駆使したダイナミクスの定量的な観察・計測と大規模なデータ解析を通じてその基本設計を理解し、複雑な多細胞システムの制御につなげることを目指しています。
主な研究項目
- 細胞が遺伝子発現情報を処理して形態形成を駆動するルール
- 組織の形態変化により遺伝子発現・細胞分化を制御する仕組み
- 胚発生における細胞分化ダイナミクスの網羅的解析
- 1細胞・空間ゲノミクス解析技術の開発と応用
竹岡研究室 研究概要
研究内容
主な研究項目
- 脊髄における学習と記憶
- 感覚統合と運動適応のメカニズム
- 感覚運動回路の結合性と機能